Om eGFR
Uppskattning av njurfunktion med ekvation i kunskapsstödet Janusmed njurfunktion
Janusmed njurfunktion utvecklas och förvaltas av Hälso- och sjukvårdsförvaltningen i Region Stockholm (tillhandahålls för alla regioner via janusmed.se. Möjlighet finns att integrera Janusmed njurfunktion som en funktion i journalsystem via Ineras Svenska informationstjänster för läkemedel). I kunskapsstödet beräknas kreatininbaserat eGFR med LM-rev (Lund-Malmöformeln). Cystatin C-baserat eGFR kan fyllas i manuellt från labblistan (för cystatin C-baserad skattning rekommenderas CAPA-formeln). Om både eGFRcystatin C och eGFRkreatinin finns presenteras ett kombinerat eGFR (medel-eGFR).
- LM-rev valdes på grund av att formeln visat sig bäst överensstämma med uppmätt GFR i den svenska populationen1,2.
- Vid en jämförelse med uppmätt GFR står sig framförallt CKD-EPI och LM-rev bättre än C-G3.
- eGFR från standardiserat cystatin C beräknat med CAPA-formeln har visat god tillförlitlighet i den svenska populationen4.
- Kombinerat eGFR från både eGFRcys och eGFRkrea förbättrar tillförlitligheten i de flesta grupper5,6. Medelvärdet av de två skattningarna är en bra skattning i de flesta fall. Men när skattningarna ligger långt ifrån varandra >30 % bör man göra en rimlighetsbedömning om det finns individuella faktorer som gör att eGFR från antingen kreatinin eller cystatin C är bättre än ett kombinerat värde.
- Absolut GFR (ej normerat till kroppsyta) är standard för underhållsdosering av läkemedel7,8,9. I de fall patientens kroppskonstitution avviker från normalen uppmanas till beräkning av absolut GFR.
- I de fall där läkemedelskoncentrationen är avgörande för effekt, vid ett smalt terapeutiskt intervall, och där risken för allvarliga biverkningar föreligger vid hög koncentration rekommenderas i första hand koncentrationsbestämningar av läkemedlet alternativt att göra en mätning av GFR med till exempel iohexolclearance7,8,9 för beräkning av dos.
Bakgrund
Kronisk njursjukdom (CKD) är en gemensam benämning för ett flertal underliggande sjukdomar som påverkar njurarnas funktion med risk för allvarlig sjukdom som medför stora konsekvenser för de drabbade. De vanligaste orsakerna till CKD är diabetes mellitus, arterioskleros och hypertoni som alla kan ge progredierande njurfunktionsnedsättning. Njurfunktionsnedsättning ökar i sin tur risken att drabbas av kardiovaskulära sjukdomar såsom hjärtinfarkt och stroke och den totala mortaliteten ökar successivt. Den ålders- och könsstandardiserade dödligheten är flerfaldigt högre för en patient med kronisk njursjukdom i stadium 4 jämfört med en person med normal njurfunktion. Även risken att bli vårdad på sjukhus ökar med avtagande njurfunktion.10
Njurfunktion mäts vanligen i termer av glomerulär filtration (GFR), vilket avser den andel av plasmavolymen som på en viss tid filtreras genom njurens glomeruli och bildar primärurin. Normalt är GFR >90 ml/min/1,73m2. Njursvikt definieras som CKD stadium 5, GFR <15 ml/min/1,73m2.
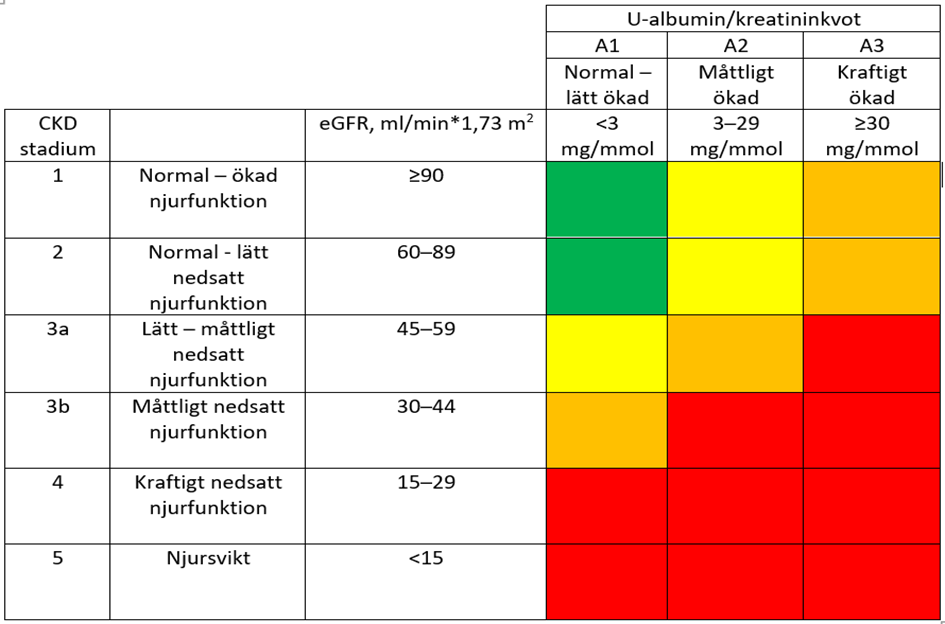
Den gällande stadieindelningen av CKD är framtagen av organisationen KDIGO (Kidney Disease Improving Global Outcome) 2012. Stadieindelningen baseras på en kombination av estimerat GFR (eGFR), albuminurigrad och orsak.11 För CKD-diagnos krävs två mätningar med minst tre månaders intervall. CKD stadie 1-2 innefattar även patienter med normal njurfunktion och då krävs samtidig förekomst av annat tecken på njurskada, till exempel albuminuri >3 månader, biopsiverifierad njursjukdom eller radiologiskt diagnostiserad njursjukdom. I stadie 3-5 räcker bestående njurfunktionsnedsättning (eGFR <60 ml/min/1,73m2 >3 månader) för CKD-diagnos. Riskökningen i olika CKD- och albuminuri-stadier för utfallen njursvikt, kardiovaskulär och total mortalitet i visas i tabell 1.
Tabell 1. Stadieindelning av kronisk njursjukdom (CKD). Färgerna indikerar riskökning för komplikationer (progress till njursvikt, kardiovaskulära händelser och mortalitet). (Låg risk – grön, måttlig risk – gul, hög risk – orange, mycket hög risk – röd.
Njurfunktion
Mätning av njurfunktionen är central inom njurmedicin. För att korrekt kunna mäta den glomerulära funktionen krävs ett ämne som enbart filtreras i njuren, till skillnad från ämnen som även utsöndras eller återresorberas aktivt i njurtubuli. Ett sådant ämne är polysackariden inulin. Clearance av inulin (den volym av blod som helt filtreras från inulin på en given tid) har varit ”gold standard” när det gäller att mäta GFR, men finns inte tillgängligt för klinisk användning. Andra metoder att mäta GFR som anses mer eller mindre likvärdiga med inulin är I-iothalamate, Tc-DTPA, Crome-EDTA och iohexolclearance12. Dessa metoder är dock både tidskrävande och kostsamma. I Sverige är iohexolclearance den vanligaste metoden. Vid undersökningen ges en standardiserad dos av iohexol och plasmakoncentrationen följs med upprepade eller enstaka prover under 4 – 24 timmar beroende på skattad njurfunktion.
För att lättare kunna uppskatta GFR används idag så kallade endogena markörer, det vill säga ämnen som är kroppsegna och också filtreras fritt i njurarna. Den vanligaste endogena markören är kreatinin, en nedbrytningsprodukt av musklernas kreatinfosfat. Kreatinin produceras och filtreras med en konstant hastighet i kroppen under ”steady-state”-betingelser. En liten andel av vårt kreatinin utsöndras också aktivt i njurtubuli. Även om denna andel är liten ökar betydelsen ju lägre njurfunktionen blir. Kreatininclearance (CrCl) är således en ganska god approximation av GFR, men överskattar njurfunktionen vid låga GFR. Kreatinin har även andra svagheter som markör för njurfunktion. Individer med lägre muskelmassa, t.ex. kvinnor, äldre, och malnutrierade med undervikt har lägre kreatininvärden. Den inter-individuella variationen är mycket stor. Hos många medelålders-äldre stiger inte P-kreatinin över referensvärdena förrän njurfunktionen minskat med cirka 50 %12 och om förhöjt P-kreatininvärde används som markör, upptäcks njurskadan mycket sent. Detta har medfört att man under många år utvecklat formler som tar hänsyn till dessa inter-individuella olikheter och som är bättre på att uppskatta GFR än P-kreatinin enbart.
Uppskattning av njurfunktion med formelclearance
Den tidigare mest använda formeln är Cockcroft–Gault (C-G)13. Den baseras på P-kreatinin mätt med alkalinpicrat med deproteinisering (ej standardiserat värde), ålder, kön och vikt och ger en uppskattning av CrCl. C-G har således samma felkällor som uppmätt CrCl och ger en uppskattning av den absoluta njurfunktionen som inte är normerad efter kroppsyta. Under senare år har det utvecklats bättre metoder att skatta GFR (eGFR) från kreatininvärden.
Den formel som till en början fick störst genomslagskraft internationellt är 4-variabel-MDRD-formeln som kom i sin första form 199914. Den baserades på P-kreatinin mätt med kinetisk alkalinpicrat. MDRD uppskattar den kroppsytenormerade njurfunktionen utifrån P-kreatinin, ålder, kön och etnicitet (afroamerikan eller inte). Senare (2006) kom en ny ekvation som var justerad till de införda internationella standardiserade P-kreatininvärdena som ger jämförbara värden oavsett om analysen sker med kinetisk alkalinpicrat eller enzymatisk metod15. En vidareutveckling av eGFR som kom 2009 är den kreatininbaserade formeln CKD-EPI16. CKD-EPI är enbart anpassad till den nya standardiserade P-kreatininmetoden som används i Sverige idag. Den population som ligger till grund för CKD-EPI är större (ca 5000 personer) och inkluderar fler friska individer med normal njurfunktion. Detta medför att CKD-EPI ger mer rättvisande (högre) GFR i normalintervallet jämfört med MDRD. Etnicitet är en variabel också i CKD-EPI. Den beräknade njurfunktionen för personer med afroamerikanskt ursprung ligger något högre jämfört med vita vid motsvarande P-kreatininvärde. Det finns ytterligare en GFR-ekvation vilken utvecklats i Sverige, Lund-Malmö-formeln (LM)17,18. Även den ekvationen är anpassad till de nya standardiserade P-kreatininvärdena. Ekvationen finns i flera varianter, bland annat med justering för kroppsmassa3,18,19. Den version som använts mest i klinisk praxis kallas LM-rev 3,18. Nyligen har en ny LM-version framtagits, LM18, som även kan användas för skattning av GFR hos barn20.
Det har gjorts många jämförelser mellan de olika kreatininbaserade GFR-ekvationerna. I den SBU-rapport som publicerades 2013 finns en noggrann jämförelse mellan de mest använda ekvationerna3. Slutsatsen var att både MDRD, CKD-EPI, och LM-rev hade tillräcklig noggrannhet (>75 % av estimaten inom 30 % av referensmåttet [P30]), med undantag för patientgrupper med låg body mass index (<20 kg/m2) eller låg GFR (<30 ml/min/1,73m2).
C-G hade otillräcklig noggrannhet, särskilt vid låg GFR. Hos äldre individer >80 år ansågs CKD-EPI och LM-rev ha tillräcklig noggrannhet. I en senare analys med data från Svenskt njurregister av patienter med GFR <30 ml/min sågs att endast LM-rev hade P30 >75% i den svenska populationen21. Senare jämförelser har visat att LM-rev är den GFR-ekvation som har bäst noggrannhet i den svenska populationen1, även hos äldre2.
Cystatin C – en ny markör för njurfunktion
En annan endogen markör för njurfunktion som vunnit genomslag i Sverige är cystatin C4,22. Cystatin C är en proteasinhibitor och filtreras fritt i glomeruli. Jämfört med P-kreatinin är cystatin C en mer stabil markör som är mindre känslig för födointag, kroppskonstitution, ålder och kön4. Cystatin C-beräknat eGFR ger kroppsytenormerad njurfunktion. Även cystatin har felkällor. Thyreoideadysfunktion, graviditet, och eventuellt cellsönderfall vid vissa maligna sjukdomar kan ge ett avvikande cystatin C-värde, vilket kan medföra en felaktig skattning av eGFR. Vid medicinering med höga doser kortikosteroider stiger ofta p-cystatin C vilket kan ge en felaktigt låg skattning av eGFR23. Cystatin C-beräknat eGFR fungerar bäst vid GFR 20–90 ml/min och har fördelen att kunna användas hos barn från cirka två års ålder utan särskilda formler. Sedan 2010 har European Commission tillhandahållit en internationell referens för cystatin C-kalibrering (ERM-DA471/IFCC). Standardiserade cystatin C-metoder används av de flesta kliniska laboratorier i Sverige. Samtidigt har en förbättrad formel för eGFR utifrån cystatin C tagits fram; CAPA (caucasian, asian, pediatric, adult)-formeln. CAPA-formeln är validerad i den svenska populationen med resultat som visar P30>80 %4.
Kombinerade formler med Cystatin C och kreatinin ger bäst tillförlitlighet
Eftersom både P-kreatinin och cystatin C har felkällor och båda var för sig kan ge upphov till värden som avviker från det uppmätta GFR-värdet så har man undersökt om en kombination av eGFR från kreatinin (eGFRkrea) och eGFR från cystatin C (eGFRcys) ger bättre tillförlitlighet5,6,24. Flera studier har publicerats om detta och sammanfattningsvis har man sett att en kombination av de båda mätmetoderna har bättre tillförlitlighet (P30 >90 %) än var och en av dem. Det har också gjorts en svensk jämförelse där den nya CAPA-formeln använts i kombination med eGFR från LM-rev, med resultat för P30 på 91 %6. I olika subgruppsanalyser kan man se att P30 blir sämre för dem med hög ålder (>80 år), låg GFR (<30 ml/min/1,73m2) och låg BMI (<20 kg/m2) även om P30 även i dessa grupper ligger runt 80 %. Även när skillnaden mellan eGFR-skattningarna är stor, är medelvärdet en bra skattning25. Man bör dock göra en rimlighetsbedömning om det finns uppenbara felkällor till endera skattningen (t ex behandling med glukokortikoider, muskelbyggare).
Läkemedelsdosering och njurfunktion
Vid dosering av läkemedel är det viktigt att ta hänsyn till njurfunktionen7. En svensk studie har visat att 11 % av patienter som blir inlagda på sjukhus blir det på grund av läkemedelsbiverkningar och att ca 25 % av dessa orsakades av en för hög dos i förhållande till njurfunktionen26. För första bedömning om ett läkemedel kan ges, där ett lägre gränsvärde för njurfunktion angivits (t ex vissa antidiabetika), är det lämpligt att använda kroppsytenormerat eGFR. Vid inledning av läkemedelsbehandling med laddningsdos ska denna anpassas till kroppsstorleken (egentligen läkemedlets distributionsvolym) för att uppnå en terapeutisk effekt. Janusmed njurfunktion ger framför allt råd om när anpassning av underhållsdosen till njurfunktionen behövs vid läkemedelsbehandling. Vid kontinuerlig behandling saknar distributionsvolymen betydelse för exponeringen, som i detta fall helt avgörs av dosen, doseringsintervallet, biotillgängligheten och patientens absoluta läkemedelsclearance. Underhållsdosen av renalt utsöndrade läkemedel ska därför anpassas efter absolut GFR och inte efter kroppsvikt. I praktiken spelar det mindre roll för de flesta vuxna patienter som har normal kroppsstorlek (kroppsyta ca 1,5 – 2,0 m2), då absolut och kroppsytenormerad njurfunktion i dessa fall ligger nära varandra. För personer med mycket avvikande kroppsstorlek kan dock absolut och relativ njurfunktion vara olika. Hos en äldre kvinna med mycket låg BMI kan till exempel kroppsytenormerad GFR vara 8–10 ml/min högre än det absoluta GFR-värdet. Det omvända förhållandet gäller överviktiga personer som får motsvarande falskt lågt normerat GFR27,28.
Den tidigare mest vanliga ekvationen som använts för att dosera läkemedel har varit estimerat CrCl med C-G. Fram till ca 2010 grundade sig läkemedelsdosering i läkemedelsprövningar på denna metod, som då avspeglade sig i rekommendationer i FASS och SPC. De uppdaterade riktlinjerna (2009 och 2020) från The National Kidney Disease Education Program (NKDEP) och FDA i USA har ändrats för att inkludera både estimerat CrCl och eGFR baserat på MDRD/CKD-EPI i rekommendationerna för läkemedelsdosering27-30. Man betonar också vikten av att räkna om kroppsytejusterat GFR på särskilt stora och små patienter till det absoluta värdet. För att göra det behövs kunskap om individens vikt och längd. Huvudsakliga argumenten mot fortsatt användning av C-G-formeln är att den är baserad på en icke-standardiserad kreatininmetod och inte uppfyller noggrannhetskriterier jämfört med modernare formler3.
Slutsats
Sammantaget konstateras att enbart ett p-kreatininvärde inte är lämpligt för bedömning av njurfunktionen eller för dosering av läkemedel. Alla metoder för att uppskatta GFR (C-G, Cystatin C, MDRD, CKD-EPI, LM-rev) är bättre än enbart p-kreatinin. I Janusmed njurfunktion ger beräkningen av eGFR en skattning av njurfunktionen att ta hänsyn till och förskrivarna har därmed fått ytterligare ett verktyg till en väl grundad egen bedömning inför varje läkemedelsordination. LM-rev-formel för eGFR-skattning har valts på grund av dess större tillförlitlighet i den svenska populationen, hos äldre, samt hos personer med låg GFR.
För individer med en kroppskonstitution som ligger nära 1,73 m2 (1,5-2,0 m2) kan eGFR från antingen LM-rev eller CAPA (cystatin C) vara ett enkelt verktyg att uppskatta njurfunktionen med och använda för läkemedelsdosering. Att använda medelvärdet av eGFR från LM-rev och CAPA ökar tillförlitligheten ytterligare i de flesta fall. När information om längd och vikt finns, bör ett absolut GFR beräknas. Detta är särskilt viktigt vid dosering av läkemedel till personer med avvikande kroppskonstitution. För läkemedel med smal terapeutisk bredd bör läkemedelskoncentrationer användas för att styra ordinationer.
Marie Evans 2015-12-03
innehåll uppdaterat Peter Bárány 2024-01-31
referenslista Ylva Askfors 2024-01-26
Referenser
- Nyman U, Grubb A, Larsson A, et al. The revised Lund-Malmö GFR estimating equation outperforms MDRD and CKD-EPI across GFR, age and BMI intervals in a large Swedish population. Clinical Chemistry and Laboratory Medicine (CCLM) 2014:815.
- Björk J, Bäck SE, Ebert N, Evans M, Grubb A, Hansson M, Jones I, Lamb EJ, Martus P, Schaeffner E, Sjöström P, Nyman U. GFR estimation based on standardized creatinine and cystatin C: a European multicenter analysis in older adults. Clin Chem Lab Med. 2018 Feb 23;56(3):422-435.
- Soveri I, Berg U, Björk J, et al. Measuring GFR: A Systematic Review. Am J Kidney Dis 2014;64:411-24.
- Grubb A, Horio M, Hansson L-O, et al. Generation of a New Cystatin C–Based Estimating Equation for Glomerular Filtration Rate by Use of 7 Assays Standardized to the International Calibrator. Clinical Chemistry 2014; 60:974-86.
- Tidman M, Sjöström P, Jones I. A Comparison of GFR estimating formulae based upon s-cystatin C and s-creatinine and a combination of the two. Nephrology Dialysis Transplantation 2008;23:154-60.
- Björk J, Grubb A, Larsson A, et al. Accuracy of GFR estimating equations combining standardized cystatin C and creatinine assays: a cross-sectional study in Sweden. Clinical Chemistry and Laboratory Medicine (CCLM) 2015:403.
- Helldén A, Rosenborg S. Läkemedelsbehandling vid njursjukdom, kap 27. Njurmedicin, 4e upplagan, red Aurell M, Samuelsson O. 2014. Liber, Stockholm. S. 341-354.
- Rowland & Tozer (ISBN 0-7817-5009-1) Clinical Pharmacokinetics and Pharmacodynamics: Concepts and Applications 4th Ed, Wolters Klua´wer Lippincott William &Wilkins ; Philadelphi, PA, 2011.
- Helander, Beck & Rosenborg, Kap 20 Läkemedel, toxiska substanser och missbruksmedel, i Laurells Klinisk Kemi i praktisk medicin (red Theodorsson & Berggren Söderlund) 10 uppl. Studentlitteratur (Lund): 2018 ISBN 978-91-44-11974-8
- Go AS, Chertow GM, Fan D, McCulloch CE, Hsu C-y. Chronic Kidney Disease and the Risks of Death, Cardiovascular Events and Hospitalization. N Eng J Med 2004;351:1296-305
- Nationellt system för kunskapsstyrning Hälso- och sjukvård. Nationellt vårdprogram för kronisk njursjukdom; version 1. Sveriges regioner i samverkan; 2021 [citerad 2024-01-26]. Hämtad från: Nationellt-vardprogram-for-kronisk-njursjukdom.pdf
- Levey A. Measurement of renal function in chronic renal disease. Kidney Int 1990; 38:167-84.
- Cockcroft D, Gault M. Prediction of creatinine clearance from serum creatinine. Nephron 1976; 16:31-41.
- Levey A, Bosch J, Lewis J, Greene T, Rogers N, Roth D. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Ann Intern Med 1999; 130:461-70.
- Levey AS, Coresh J, Greene T, et al. Using Standardized Serum Creatinine Values in the Modification of Diet in Renal Disease Study Equation for Estimating Glomerular Filtration Rate. Ann Intern Med 2006; 145:247-54.
- Levey AS, Stevens LA, Schmid CH, et al. A New Equation to Estimate Glomerular Filtration Rate. Annals of internal medicine 2009; 150:604-12.
- Björk J, Bäck S, Sterner G, et al. Prediction of relative glomerular filtration rate in adults: new improved equations based on Swedish Caucasians and standardized plasma-creatinine assays. Scand J Clin Lab Invest 2007; 67:678-95.
- Björk J, Grubb A, Sterner G, Nyman U. Revised equations for estimating glomerular filtration rate based on the Lund-Malmö study cohort. Scand J Clin Lab Invest 2011; 71:232-9.
- Nyman U, Björk J, Sterner G, et al. Standardization of p‐creatinine assays and use of lean body mass allow improved prediction of calculated glomerular filtration rate in adults: A new equatio. Scand J Clin Lab Invest 2006;66:451-68.
- Björk J, Nyman U, Delanaye P, Grubb A, Larsson A, Vranken L, Åkesson A, Pottel H. A novel method for creatinine adjustment makes the revised Lund-Malmö GFR estimating equation applicable in children. Scand J Clin Lab Invest 2020; 80: 456-463.
- Evans M, van Stralen K, Schön S, et al. Glomerular filtration rate-estimating equations for patients with advanced chronic kidney disease. Nephrol Dial Transplant 2013; 10:2518-26.
- Randers E, Kristensen J, Erlandsen E, Danielsen H. Serum cystatin C as a marker of the renal function. Scand J Clin Lab Invest 1998; 58:585-92.
- Risch L, Herklotz R, Blumberg A, Huber A. Effects of glucocorticoid immunosuppression on serum cystatin C concentrations in renal transplant patients. Clin Chem 2001; 47:2055-9
- Stevens LA, Coresh J, Schmid CH, et al. Estimating GFR using Serum Cystatin C Alone and in Combination with Serum Creatinine: A Pooled Analysis of 3418 Individuals with CKD. American journal of kidney diseases: the official journal of the National Kidney Foundation 2008; 51:395-406.
- Fu EL, Levey AS, Coresh J, Elinder CG, Rotmans JI, Dekker FW, Paik JM, Barany P, Grams ME, Inker LA, Carrero JJ. Accuracy of GFR Estimating Equations in Patients with Discordances between Creatinine and Cystatin C-Based Estimations. J Am Soc Nephrol. 2023 Jul 1;34(7):1241-1251.
- Odar-Cederlöf I, Oskarsson P, Öhlén G, et al. Läkemedelsbiverkan som orsak till inläggning på sjukhus. Läkartidningen 2008; 12:890-3.
- National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK). Chronic Kidney Disease and Drug Dosing: Information for Providers [Internet]. Bethesada, Maryland; U.S. Department of Health & Human Services (DHHS) [uppdaterad januari 2010; citerad 2024-01-26]. Hämtad från: Chronic Kidney Disease and Drug Dosing: Information for Providers (mycme.com)
- National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK). Determining Drug Dosering in Adults with Chronic Kidney Disease [Internet]. Bethesada, Maryland; U.S. Department of Health & Human Services (DHHS) [citerad 2024-01-26]. Hämtad från: Determining Drug Dosing in Adults with Chronic Kidney Disease – NIDDK
- Hudson J, Nyman H. Use of estimated glomerular filtration rate for drug dosing in the chronic kidney disease patient. Curr Opin Nephrol Hypertens 2011;20:482-91.
- Center for Drug Evaluation and Research (CDER). Pharmacokinetics in Patients with Impaired Renal Function – Study Design, Data Analysis, and Impact on Dosing [Internet]. Silver Spring, MD: Food and Drug Administration (FDA); 2024 [citerad 2024-01-26]. Hämtad från: https://www.fda.gov/media/78573/download